Medizinprodukte | Bureau Veritas
Optimieren Sie Ihr Risikomanagement über die gesamte Lieferkette von den ersten Prototypen bis zur Serienproduktion und verbessern Sie Ihre Produktsicherheit für eine effizientere Zulassung im Einklang mit den regulatorischen Anforderungen.
Entdecken Sie hier unser brandneues Labor!
Imagefilm Bureu Veritas CPS - Medizinprodukte
View this Business Unit in english here:
MEDICAL DEVICE ANALYIS
Einführung
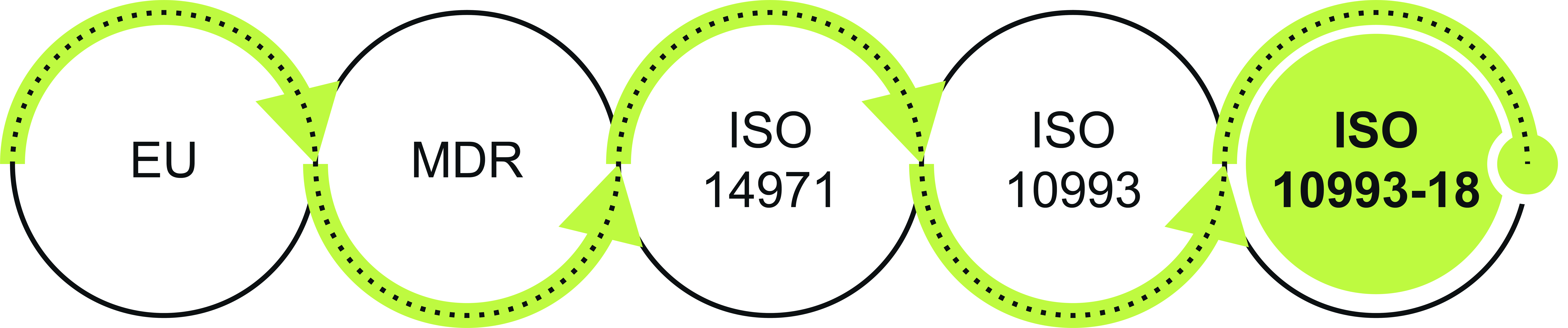
Gesetzesgrundlagen
Der Markt für Medizinprodukte ist stark reguliert. In der Europäischen Union (EU) gilt die Verordnung über Medizinprodukte (MDR), in den USA werden Medizinprodukte von der Food and Drug Administration (FDA) reguliert. Sowohl die MDR als auch die FDA legen ihre eigenen Anforderungen an Medizinprodukte und die damit verbundenen Prüfungen fest, die die Hersteller einhalten müssen.
Nach der MDR sind die Hersteller verpflichtet, dass für Medizinprodukte entstandene Risiko systematisch zu bewerten und zu erfassen. In diesem Zusammenhang können allgemeine Sicherheits- und Risikoaspekte durch Anwendung der ISO 14971 und ISO 10993 gehandhabt werden. Dabei konzentriert sich die Normenreihe ISO 10993 auf die Biokompatibilität für biologische und chemische Eigenschaften und die Patientensicherheit der betrachteten Produkte. Damit die Hersteller von Produkten die chemischen Eigenschaften zur Risikobewertung verstehen können, bietet Bureau Veritas Schwerin einen hervorragenden analytischen Service unter Verwendung der neuesten Techniken.
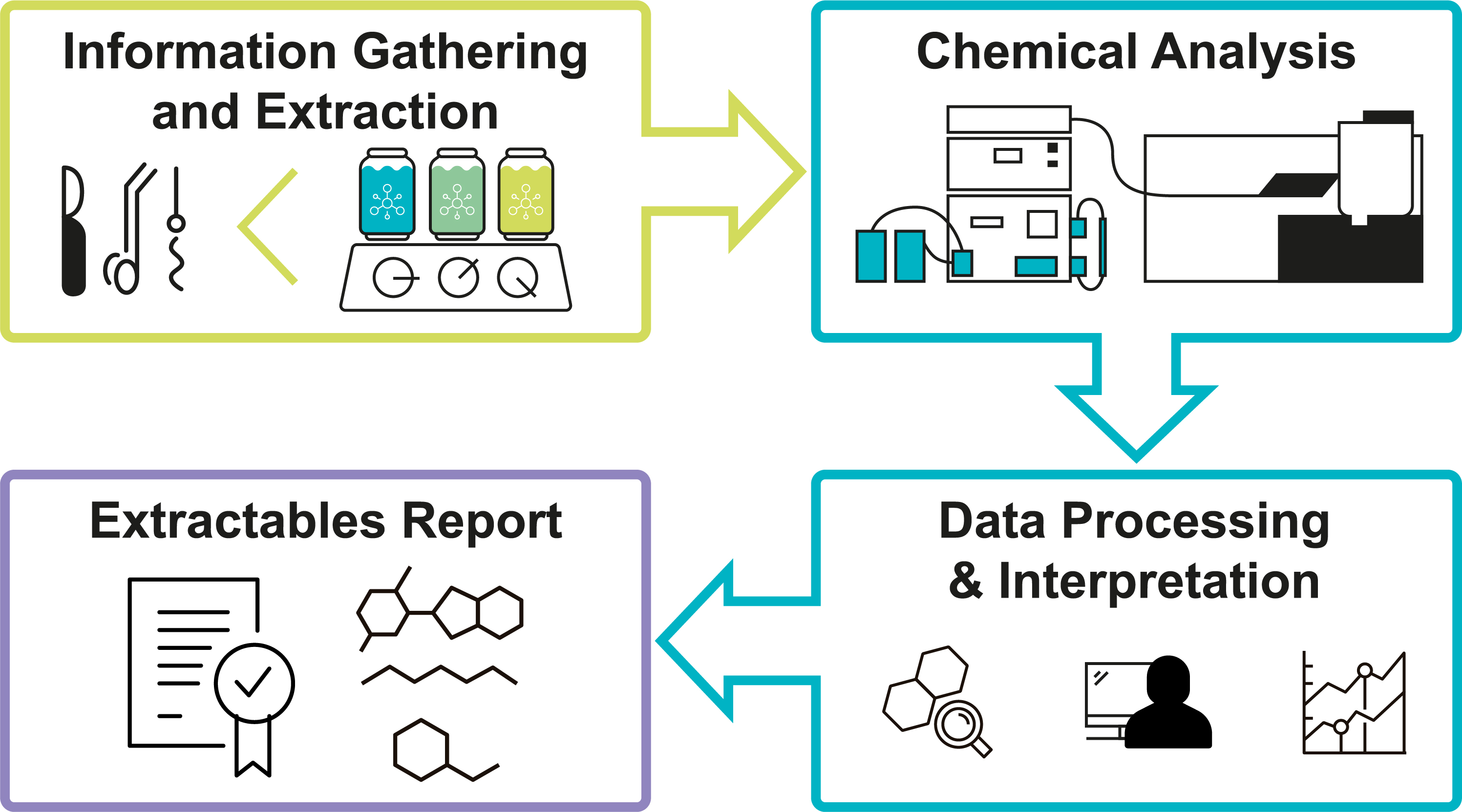
Prüfprozess
Probenvorbereitung
|
Umzug in den Neubau im Jahr 2022. Komplett neu ausgestattetes Labor mit den neuesten Geräten wie zum Beispiel: • Orbitalschüttlern |
Chemische Charakterisierung
|
Extrahierbare und herauslösbare Stoffe mit modernsten Analysemethoden |
|
Gaschromatographie (GC) |
Flüssigkeitschromatographie (LC) |
Induktiv gekoppeltes Plasma (ICP) |
Akkreditiert für Medizinprodukte
DAkkS ISO 17025 akkreditiert Sehen Sie hier unsere Urkundenanlage D-PL-12024-02-04. |
|
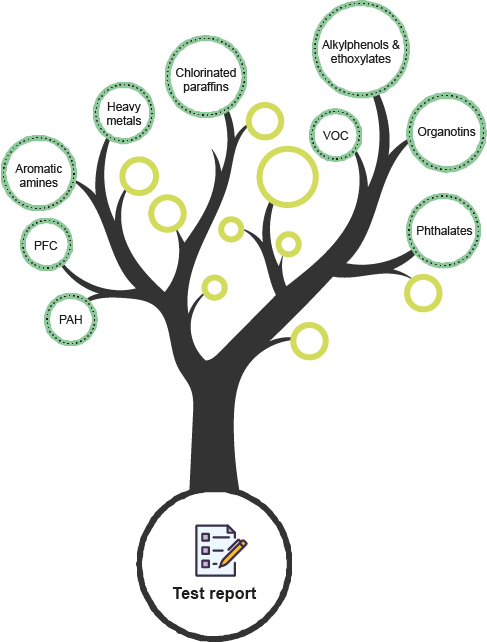
Prüfumfang
ISO 10993 Screening Analyse
Durch die Kombination unserer hochmodernen Ausrüstung und eines hochqualifizierten Teams ist Bureau Veritas (BV)-Schwerin in der Lage, eine hohe Anzahl von Substanzen zu identifizieren und zu quantifizieren. Darüber hinaus reduzieren unsere präzisen Analysen Ihre Unsicherheit auf ein Minimum, selbst bei unbekannten Substanzen. So sind Sie mit BV-Schwerin auf dem besten Weg, die Risiken Ihrer Medizinprodukte zu bewerten.
CMR Substanzen - zielgerechte Untersuchung
CMR - Stoffe sind Chemikalien, die krebserregend (carciogenic), erbgutverändernd (mutagenic) oder fortpflanzungsgefährdend (toxic for reproduction) sind. Sie werden in verschiedene Risikoklassen eingeteilt. Die Klassen Ia und Ib sind die höchsten Risikoklassen und werden daher in der MDR gesondert erwähnt. Die Verwendung solcher Stoffe ist in jedem Fall zu vermeiden und erfordert daher eine gezielte Überwachung.
BV hat eine Methode entwickelt, um gezielt nach diesen Stoffen zu suchen. Der innovative Ansatz von BV-Schwerin basiert auf einem schnellen Screening-Verfahren, das zunächst qualitativ nach den Stoffen sucht. Im Falle eines Befundes erfolgt eine Quantifizierung mit gesicherten analytischen Methoden, so dass eine exakte Konzentration bestimmt werden kann.
So profitieren Sie von einer lückenlosen Überwachung Ihrer Produkte bereits im Entwicklungsstadium. Wenn solche Stoffe bereits in Komponenten identifiziert werden, bevor sie in das Medizinprodukt integriert werden, können Ressourcen - insbesondere Zeit und Kosten - eingespart werden.
Wenn Sie mehr über diese komplexe und hochinnovative Methode erfahren möchten, nehmen Sie bitte Kontakt mit uns auf!
Kontakt
|
Andreas Dumrath |
Alexander Laubach |
|
Regulatory Affairs |
Laboratory Expert |
||
|
+ 49 40 74041 1234 |
+ 49 40 74041 0047 |
||
|
andreas.dumrath@bureauveritas.com |
+ 49 174 1753086 |
||
|
alexander.laubach@bureauveritas.com |